
病理诊断在肿瘤精准诊疗中扮演着非常重要的角色,病理检查是肿瘤诊断的金标准。
随着病理形态和分型越来越复杂,医疗行业的需求逐渐由定性判断转为预测性诊断,而当前的行业结构并不完善。
一方面,传统病理诊断已经越来越无法满足临床的需求,传统方法精确度不足,且目前国内存在医疗资源分布不均,病理科的巨大潜力有待挖掘。
另一方面,肿瘤诊断病理的重点正从靶向治疗转移到肿瘤免疫微环境研究,当前的精准医疗技术尚存在局限性,无法满足临床需求。
比如,PCR虽然使用便捷,精准度高,但检测位点单一且通量有限,限制了其在医院的应用。NGS具有快速、精准、高通量等优势,已逐步渗透到肿瘤病理分子诊断领域,但囿于其技术成本高,诊疗精细化程度不足,也存在入院方面的痛点。
临床迫切需要新的方法出现,既能够兼顾多组学研究和使用成本,又能契合当前肿瘤免疫微环境的研究,还要利于产品入院,赋能病理科发展。
阔然生物作为下一代病理技术临床应用的倡导者,已深度布局基于多重荧光免疫组化技术平台的下一代病理技术,解决肿瘤免疫微环境研究难题。阔然生物采取NGP+NGS并行发展策略,将更准确、更全面、更高效评估肿瘤免疫微环境,用于指导临床诊疗、免疫治疗疗效和预后评估。同时也将解决NGS入院难题,赋能病理科发展。
全析肿瘤微环境,NGP为肿瘤精准诊疗打开新突破口
近年来,以免疫检查点为治疗靶点的肿瘤免疫治疗取得了令人振奋的进展,为人类抗癌史添加了一个又一个的里程碑成果。
然而,肿瘤免疫治疗的疗效仅限于一部分患者,且存在明显的个体化差异。如何提高免疫治疗疗效,扩大受益人群,成为目前肿瘤免疫治疗研究的焦点问题。越来越多的证据将这种治疗结果的差别归于肿瘤微环境的异质性。
肿瘤是一个复杂的集合体,肿瘤的发生、发展、转移过程与人体免疫反应息息相关。除了关注肿瘤细胞本身,如果能够利用有效的技术手段揭示肿瘤免疫微环境的构成和动态变化特征,必将成为免疫治疗的重要进展。
评估肿瘤免疫微环境的检测技术有基因表达谱、流式细胞术和常规的免疫组化等,但这些检测技术仍存在局限。比如,转录组和流式细胞术可以分析肿瘤免疫微环境中的分子和细胞,但无法获得微环境中分子和细胞的原位空间信息。常规免疫组化能够获得细胞和分子的原位信息,但无法同时获得超过3种指标和细胞的原位信息和细胞间的相关作用信息。
随着多组学研究和肿瘤免疫微环境研究的临床价值深入人心,肿瘤精准诊断正在从NGS向以多重荧光免疫组化(mIHC)技术为代表的下一代病理(NGP)技术发展。
不同于常规免疫组化的定性分析,多重荧光免疫组化技术在多标染色、光谱成像和智能分析等方面都做出了技术革新,克服了传统病理的单标和定性分析的局限,以及基因表达谱和流式细胞术无法获得蛋白和细胞的原位空间信息的技术缺憾,在分析肿瘤免疫微环境方面有其无法替代的明显优势。
通过多重荧光免疫组化技术,能够获得关于细胞组成和空间排列的多通道信息,从而对肿瘤微环境进行高维分析,更加深入地了解肿瘤的发生机制,也更有可能预测肿瘤对治疗的反应,精准筛查免疫治疗获益人群。
数字病理潜力显现,
NGP有望快速实现落地
当前,在精准医学的时代背景下,传统诊断病理学面临着前所未有的机遇和挑战,数字病理,特别是其在组织生物标志物识别上的应用,已成为精准医学的关键基础。
目前,数字病理在生命科学研究市场的需求渗透率已达2/3,而在大型医院和参考实验室中则占据1/3。数字病理在临床需求方面有着巨大的增长潜力。由于临床实验室和病理科室医生日益认识到数字病理的重要性,其需求正在增长。
另一方面,病理医师的短缺现象仍然严峻。目前我国的执业病理医生不足2万人,按照国家卫健委每100张病床配备1至2名病理科医师的配置要求计算,病理医生缺口超过9万人。病理资源分布不均、医生诊断时间长、效率低、超负荷工作等都是病理诊断行业面临的主要痛点。
病理医师的数量明显无法满足临床发展的需求,已经成为无法回避的问题。当前,病理诊断技术还没有实现颠覆性突破,以多重荧光免疫组化为核心的下一代病理技术在肿瘤免疫微环境研究方面具有核心优势,检测通量可控且无开机通量限制,还有现成的收费模式,有望快速在病理科实现落地,助推数字病理转型,赋能病理科发展。
基于此,阔然生物在行业内率先开展多重荧光免疫组化技术的临床转化研究,并首创了NGP+NGS的整合共生模式,打造集染色、成像、分析于一体的下一代病理解决方案。
NGP与NGS技术相互补充,从DNA和蛋白质层面检测肿瘤预后、用药相关的分子标志物,全面评估肿瘤环境,可以确定最佳的治疗方案。NGP+NGP技术能够更准确更全面的评估肿瘤突变谱和免疫微环境相关标志物,在指导用药、疗效监测和预后评估以及新药研发方面都有独特的优势。
多重荧光免疫组化解决方案上市,
加速下一代病理产业化进程
早在2019年,阔然生物就开始在肿瘤免疫微环境分析行业上下游进行布局,并整合Kreep多色荧光染色试剂盒、Krast全自动染色机、KR-HT5高通量荧光病理切片扫描仪、KRIAS医学病理影像分析系统,形成了针对肿瘤微环境全方位分析的整体解决方案。
首先,该方案中的多色荧光标记允许在单一样本上标记多种目标,从而揭示肿瘤微环境中的深度信息。通过数字病理学的理念,可以利用先进的成像技术和荧光标记的多通道信息,同时检测多个生物标志物,实现对肿瘤微环境中不同细胞类型的精准定位和鉴定。


其次,配合KR-HT5的多光谱重叠拆分技术,可以获取到高质量、高解析度的图像。数字病理学的理念强调了图像数字化和高通量成像的重要性,通过多光谱成像技术,可以同时获取多个荧光通道的信号,获得更全面、细致的肿瘤微环境图像,进一步揭示其中的细微变化和相互关系。

最后,KRAIS智能软件分析的应用,可以有效地处理和分析这些复杂的数据,把大量图像转化为可解析的信息。数字病理学的理念借助人工智能和机器学习等技术,能够对海量的图像数据进行快速准确的分析和解读,帮助病理医生发现潜在的生物标志物、病理特征和治疗指标,为科研及临床提供更深入的洞察和精确的结果。
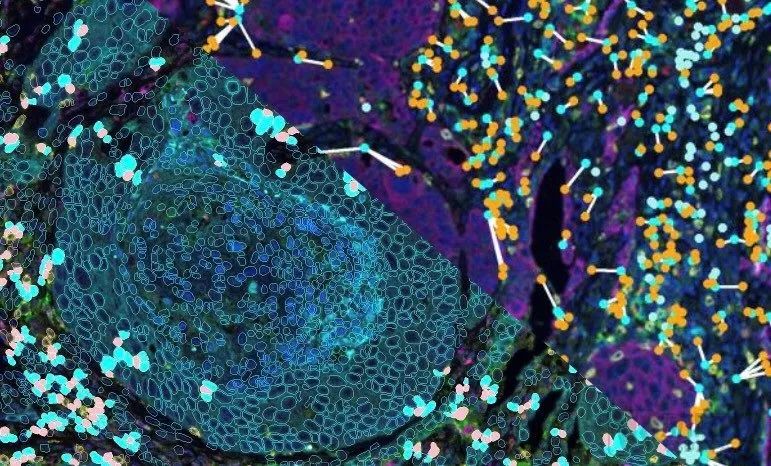
目前,多重荧光免疫组化技术平台已在多个临床应用场景中展现出潜力,并获得了广泛的认可。
比如,复旦大学上海医学院病理学系朱虹光教授就曾表示,多重荧光免疫组化技术可以帮助筛选更精准的免疫治疗获益群体,真正提高患者在免疫治疗中的有效获益,同时极大节省医疗费用支出。
同济大学附属上海市肺科医院肿瘤科主任周彩存教授认为,通过多重荧光免疫组化技术平台不仅可以看到PD-L1、PD-1的表达,还可以看到各类肿瘤浸润淋巴细胞的表达及其空间位置关系,掌握的生物学信息越多,对临床的帮助越大。
宁波市临床病理诊断中心的消化病理亚专科带头人汪春年教授在此前的分享中提到,多重荧光免疫组化技术是近几年来研究的热点技术,在消化道的肠癌、胃癌、食管癌领域都有不同方向的研究成果。
目前,阔然生物的全新多重荧光免疫组化解决方案即将全面上市,标志着中国在肿瘤微环境研究中的领先地位,也进一步推动人类在抗击癌症的征程上迈出新的步伐。
根据共研网《2022年中国免疫组化产业链及市场规模分析》数据,2020年全球免疫组化市场规模30.56亿美元,2021年约为33.75亿美元,2022年达到36.82亿美元。中国免疫组化市场规模在2020年达到27亿元,2021年约为39.55亿元,2022年增长至44.69亿元。
同时,2021年3月弗若斯特沙利文发布的《中国创新生物药市场研究报告》数据显示,预计2025年中国PD-L1/PD-1抑制剂市场规模可达90亿元以上。根据我国五大单抗药物年治疗费用对比,每个患者平均年治疗费用约为18万,可测算得出2025年我国PD-L1/PD-1用药人数约为50.06万人,2025年NGP在PD-L1检测这个细分领域的临检市场容量约为20.02亿元。
虽然未来市场空间潜力很大,但目前多重荧光免疫组化技术还正处于从科研向应用转化的关键阶段。阔然生物多重荧光免疫组化解决方案的全面上市,将加速下一代病理的产业化进程,推动肿瘤精准诊疗再升级,赋能病理科发展。
未来,多重荧光免疫组化技术或将成为继NGS之后,病理科的下一个应用增长点。我们也期待有更多如阔然生物这样的企业,联合第三方医学检验实验室、科研机构、药厂等行业各方,共同推动下一代病理的行业共识和标准化开展,加速技术的产业化落地。
注:文中【我国五大单抗药物年治疗费用】是根据百时美施贵宝、默沙东、君实生物、百济神州以及恒瑞医药的年报数据测算,将五大单抗品牌的销售额与治疗费用进行测算并对比得出。

