多靶点描绘复杂的肿瘤微环境对于全面评估患者的预后和接受免疫抑制剂治疗的疗效,挖掘肿瘤微环境与肿瘤发生发展、复发、转移和耐药机制的关系和临床分子机理提供了全新的思路,依托下一代病理技术(NGP),即多重荧光免疫组化技术平台,阔然基因推出了肿瘤免疫微环境全景分析解决方案,助力于更精确的肿瘤免疫和其他药物开发应用。
本期NGP资讯,将为大家分享两篇NGP在肝细胞癌研究中的应用案例。
肿瘤浸润淋巴细胞(TILs)与大多数癌症的存活率密切相关,但是,驱动各癌种预后效应的肿瘤浸润淋巴细胞的亚群仍不明确,阻碍了更有效的免疫疗法的开发。
为了明确TIL亚群对高级别浆液性卵巢癌 (HGSC)的预后影响,该研究通过高维流式细胞术、单细胞测序和多重荧光免疫组化技术(mIHC)评估了CD8+ TIL和CD4+ TIL共表达CD39、CD103 和 PD-1 及其组合的表型和预后价值。研究结果表明:CD39、CD103和PD-1的共表达将CD8+TIL和CD4+ TIL的亚群划分为高度活化/耗竭的表型;CD39+ CD103 + PD-1 +CD8+ TIL表现出降低的T细胞受体 (TCR)多样性并表达参与溶细胞和体液免疫的基因,TIGIT在该亚群上的表达显著上调;CD39+ CD103 + PD-1 +CD4+ TIL表现出更高的TCR多样性和肿瘤驻留表型。与表达这些标志物的其他组合的TILs相比,三阳性TILs显示出更好的预后。
该研究表明,PD-1、CD39和TIGIT通路的联合拮抗可能是增强HGSC和相关恶性肿瘤中CD39+ CD103 + PD-1 +CD8+TIL活性的有效手段,值得进一步研究。
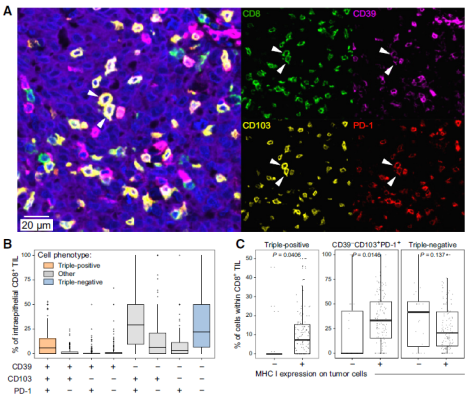
高级别浆液性卵巢癌 (HGSOC) 是一种极具侵袭性的妇科恶性肿瘤,对免疫治疗的临床响应不佳。尽管T细胞浸润与其预后之间存在相关性, 但主动识别肿瘤抗原的TILs类型仍不明确。
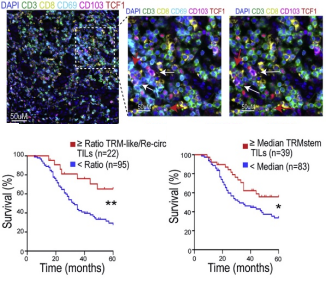
最新研究发现,卵巢癌浸润性T细胞中肿瘤识别的标志主要局限于组织驻留记忆 (TRM) 细胞;通过对TRM细胞的单细胞RNA/TCR/ATAC测序发现,TRM样TILs有不同的表型和克隆型,表现出很强的抗肿瘤活性的分化路线,只有13%干细胞样的TILs能分化成TRMstem细胞;通过多重荧光免疫组化技术(mIHC)表征122例HGSOC肿瘤样本中TRMstem细胞的浸润情况,发现TRMstem细胞密度为代表的几个指标均能体现出与预后的相关性。
该研究为卵巢癌的免疫生物学提供了新见解,为改善对大多数卵巢癌患者无效的免疫疗法提供了新的机会。
目前,阔然基因已经布局了整套多重荧光免疫组化技术(mIHC)平台,包括Kreep染色试剂盒、KR-HT5高通量荧光病理切片扫描系统和KRIAS医学病理影像分析软件,并开发了6款检测产品。
三大技术突破

依托多重荧光免疫组化技术平台,阔然基因推出了肿瘤免疫微环境全景分析解决方案,全景剖析肿瘤免疫微环境中的杀伤性T细胞、耗竭性T细胞、巨噬细胞、B细胞、三级淋巴结构和免疫检查点受体的浸润情况,全面评估患者的预后和接受免疫抑制剂治疗的疗效,挖掘肿瘤免疫微环境与肿瘤发生发展、复发、转移和耐药机制的关系和临床分子机理。
参考文献:
[1] Clin Cancer Res; 27(14) July 15, 2021.
[2] Cancer Cell.2022; 9;40(5):545-557.e13.

