多靶点描绘复杂的肿瘤微环境对于全面评估患者的预后和接受免疫抑制剂治疗的疗效,挖掘肿瘤微环境与肿瘤发生发展、复发、转移和耐药机制的关系和临床分子机理提供了全新的思路,依托下一代病理技术(NGP),即多重荧光免疫组化技术平台,阔然基因推出了肿瘤免疫微环境全景分析解决方案,助力于更精确的肿瘤免疫和其他药物开发应用。
本期NGP资讯,将为大家分享两篇NGP在黑色素瘤研究中的应用案例。
肿瘤内溶瘤病毒治疗或可通过触发肿瘤微环境的促炎重构来克服抗PD(L)-1的耐药性。
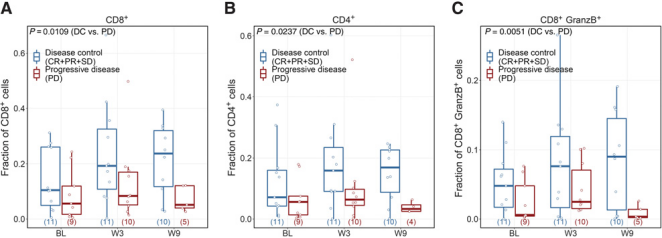
该研究初步探讨了ONCOS-102(表达GM-CSF的溶瘤腺病毒)联合PD-1单抗治疗抗PD-1耐药的黑色素瘤患者疗效。当ONCOS-102(表达GM-CSF的溶瘤腺病毒)被注射后,研究者发现疾病控制的患者中持续的免疫相关基因表达和T细胞浸润,其在第9周持续存在,与临床获益相关,表明ONCOS-102能持续促进T细胞的浸润,特别是细胞毒性CD8+T细胞,进而促进患者的临床获益。
研究发现在对抗PD-1治疗耐药的晚期黑色素瘤患者中,ONCOS-102联合pembrolizumab治疗耐受性良好,使抗PD-1耐药晚期黑色素瘤患者获得了客观缓解。未来对抗PD-1耐药黑色素瘤患者进行ONCOS-102联合检查点抑制剂的进一步研究是有必要的。
CD47蛋白簇在各种恶性细胞上大量表达,抑制巨噬细胞和树突状细胞的吞噬功能。CD47高表达水平与癌症生存期差相关。
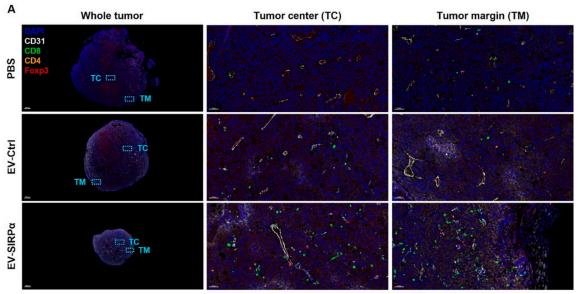
研究者为了开发安全有效的CD47阻断剂,设计了含有信号调节蛋白 α 的细胞外囊泡 (EV-SIRPα)。多重荧光免疫组化(mIHC)图像表明,与对照组相比,局部注射EV-SIRPα显著增加了肿瘤中心(TC)和肿瘤边缘(TM)中CD8+ T细胞浸润,CD4+ T细胞在TC中的比例也有增加。负载阿霉素的EV-SIRPα治疗方法在代表性免疫学冷肿瘤模型B16F10中得到80%的完全缓解。
研究结果揭示了EV-SIRPα诱导的级联免疫反应,重塑了肿瘤免疫微环境,显著增强了活化T细胞的浸润,与EV-SIRPα在“冷肿瘤”中显示出的显著疗效,表明EV-SIRPα具有成为安全有效的癌症免疫治疗药物的潜力。
目前,阔然基因已经布局了整套多重荧光免疫组化技术(mIHC)平台,包括Kreep染色试剂盒、KR-HT5高通量荧光病理切片扫描系统和KRIAS医学病理影像分析软件,并开发了6款检测产品。
三大技术突破

依托多重荧光免疫组化技术平台,阔然基因推出了肿瘤免疫微环境全景分析解决方案,全景剖析肿瘤免疫微环境中的杀伤性T细胞、耗竭性T细胞、巨噬细胞、B细胞、三级淋巴结构和免疫检查点受体的浸润情况,全面评估患者的预后和接受免疫抑制剂治疗的疗效,挖掘肿瘤免疫微环境与肿瘤发生发展、复发、转移和耐药机制的关系和临床分子机理。
参考文献:
[1] Clin Cancer Res.2022 Sep 16;CCR-22-2046.[2] J Control Release.2022 Oct 7;351:727-738.

