脑膜瘤是一种起源于脑膜上皮细胞的肿瘤,约占所有中枢神经系统新诊断肿瘤的37.6%[1]。在具有WHO分级记录的脑膜瘤中(65.7%),35.9%的脑膜瘤为WHOⅠ级,8.2%为Ⅱ级,0.7%为Ⅲ级[2]。II级脑膜瘤术后复发率29%-52%[3]。III级非常罕见,预后不良,其中位OS为2.9年,5年OS约为40%[4]。
基因表达的表观遗传调控,如DNA甲基化和组蛋白修饰等,在脑膜瘤的发生发展中起着重要的作用。研究表明,异常的DNA甲基化是脑膜瘤最常见的表观调控之一,而且结合DNA甲基化进行分子分层,相比于WHO分级,更能对脑膜瘤的预后进行精准预测[5]。
Zeste基因增强子同源物2(enhancer of Zeste homolog 2,EZH2) 是一种重要的甲基转移酶,能够通过调控转录活性进而促进肿瘤细胞的增殖、转移和耐药。在胶质瘤、肺癌、结直肠癌等恶性肿瘤中高表达,并且与不良预后有关[6-8]。但在脑膜瘤中的研究尚缺乏,因此,本文总结了EZH2在脑膜瘤中的相关研究进展。
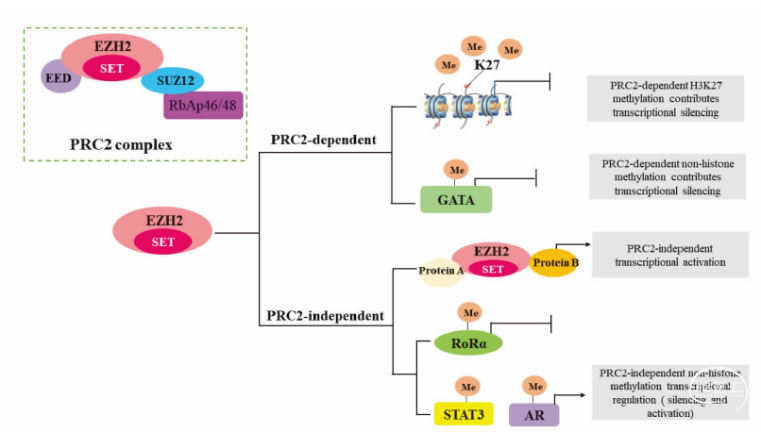
EZH2是PeG蛋白家族的主要成员之一,是多梳抑制复合物2(PRC2)的核心亚基之一,该亚基由其他几个成分组成,如EED、SUZ12和RpAp46/489。能通过其C端SET结构域催化组蛋白H3K27me3和非组蛋白,促进染色质浓缩,调控相关靶基因的表达[9]。
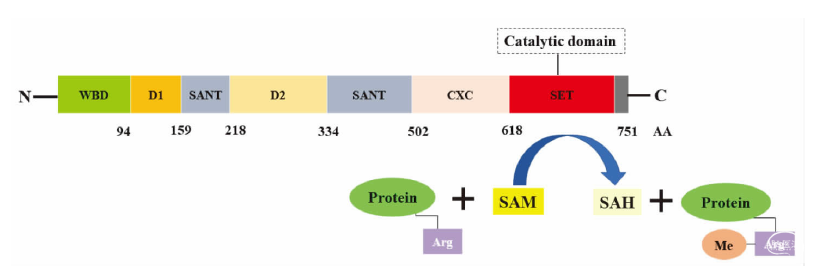
图1. EZH2的功能域示意图及SET结构域催化蛋白质上的赖氨酸残基甲基化的机制
(1)最早、最经典的的作用机制便是EZH2与其它亚基组成PRC2复合物,通过SET结构域对细胞核中的底物组蛋白H3中27位的赖氨酸残基三甲基化(H3K27me3),导致目标基因的沉默。(2)由EZH2组成的PRC2复合物还可以作用于非组蛋白,导致其甲基化,参与转录调控。(3)EZH2还可通过非PRC2依赖的方式引起非组蛋白的甲基化。(4)EZH2还能通过直接与其它因子形成转录复合物,而不需要依赖PRC2,激活下游的目标基因转录。[10,11]
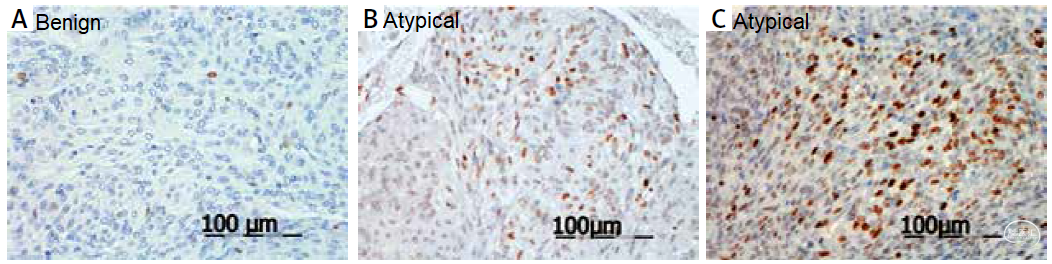
在一项149例脑膜瘤(I级102例,II级47例)的研究中,EZH2的免疫组织化学表达在II级肿瘤中明显高于较低级别肿瘤(38.3%比6.0%;p<0.001)。大多数阳性病例显示低表达水平,仅在2例非典型脑膜瘤中检测到EZH2的强表达。凸面脑膜瘤的EZH2表达比颅底更高(19.5%比6.3%)。EZH2免疫阳性在增殖活性高的区域更为明显。EZH2表达高的病例其增殖活性(MIB-1 LI)显著高于阴性病例(平均值±SD–7.9±6.2 vs 3.7±3.3;p<0.001)[12]。在mRNA转录分析中也验证了EZH2在非典型脑膜瘤中的表达更高[13]。此外,研究还发现,EZH2在复发性脑膜瘤中的表达更高[14]。

图3. EZH2在脑膜瘤中的表达。A, B, C:EZH2免疫组化在脑膜瘤中表达阴性,低表达和高表达;D:mRNA转录结果表明EZH2在非典型脑膜瘤中高表达;E:EZH2在复发组(红色)比未复发组表达更高(p=0.003)
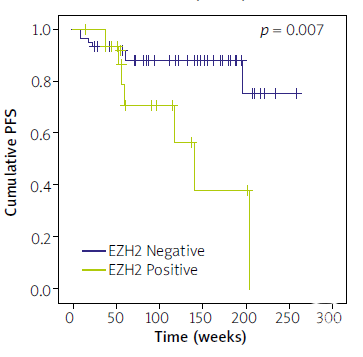
研究发现,EZH2是脑膜瘤无进展生存期的独立影响因素,与阴性病例相比,EZH2表达阳性的病例,其无进展生存期明显缩短(平均PFS 135.4 vs 223.7周;p=0.007)[12]。
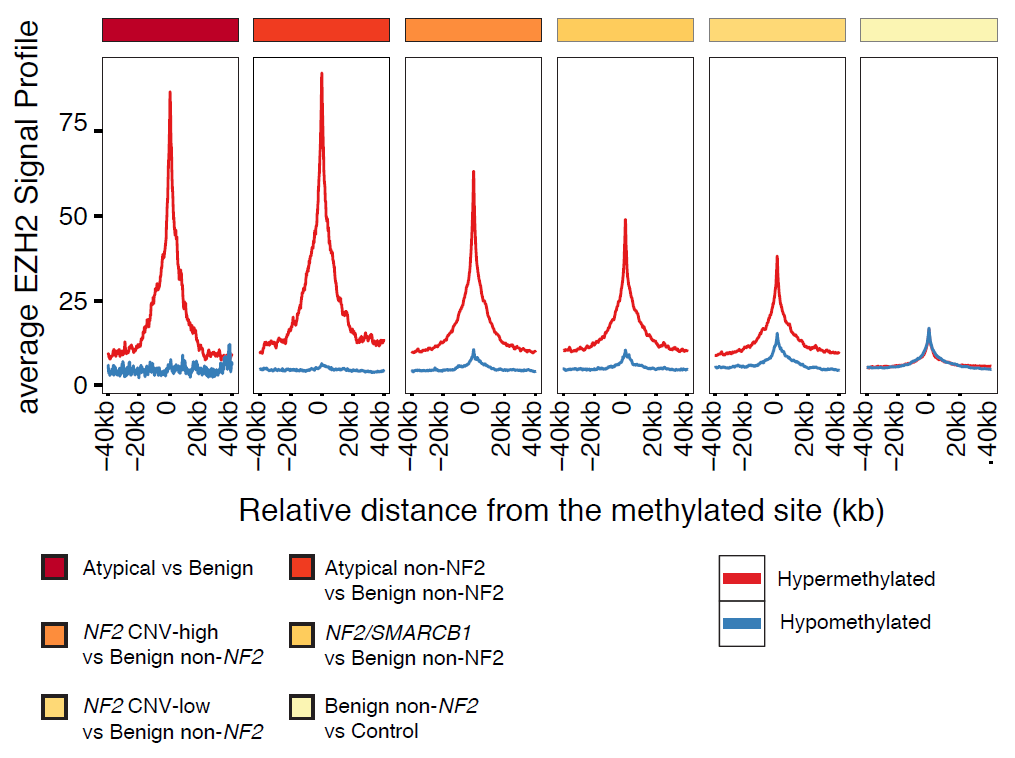
研究发现非典型与良性样本中ESCs中H3K27me3和EZH2靶点的超甲基化增加,超甲基化水平与非典型的可能性相关。研究者还发现let-7家族的5个成员(let-7a, let-7b, let-7c, let-7d, let-7e)在非典型脑膜瘤中有异常表达。该miRNAs家族已被证明在各种癌症,如前列腺癌和神经母细胞瘤中表达下调。研究发现非典型脑膜瘤中let-7家族的下调与EZH2mRNA表达的上调相关。重要的是,除let-7b外,这些miRNA的表达水平(在非典型脑膜瘤和良性脑膜瘤中分别缺失75%和47%)不受CNV事件的影响。[13]
显示了以高甲基化(红线)和低甲基化(蓝线)位点为中心的EZH2-ChIP-seq信号(先前在hESCs中报道)的聚集图。分析显示非典型与良性样本中ESCs中H3K27me3和EZH2靶点的超甲基化增加。超甲基化水平与非典型的可能性相关。
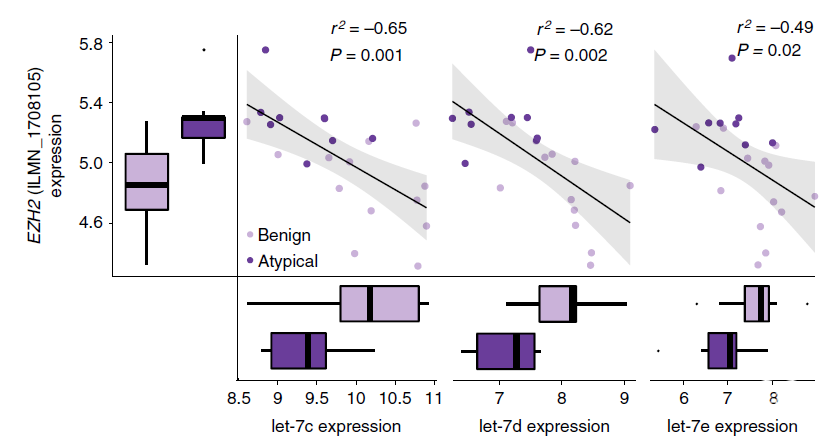
图6. Let-7家族在非典型脑膜瘤中的下调与EZH2 mRNA表达的上调相关
EZH2是表观遗传学方面的重要基因,在多种恶性肿瘤的已被广泛研究,但在脑膜瘤中的研究尚缺乏。目前的研究发现EZH2在非典型脑膜瘤中高表达,并且与不良预后相关,let-7家族负调控着EZH2的表达。由于EZH2复杂的作用机制,既可以甲基化组蛋白和非组蛋白,也可以通过PRC2依赖和非PRC2依赖的方式,导致基因沉默或转录激活。因此,EZH2在脑膜瘤中的作用及机制仍需要进一步研究。
参考文献:
[1]Louis DN, Perry A, Wesseling P, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro-oncology. 2021;23(8):1231-1251.
[2]Hale AT, Wang L, Strother MK, Chambless LB. Differentiating meningioma grade by imaging features on magnetic resonance imaging. Journal of clinical neuroscience : official journal of the Neurosurgical Society of Australasia. 2018;48:71-75.
[3]Kshettry VR, Ostrom QT, Kruchko C, Al-Mefty O, Barnett GH, Barnholtz-Sloan JS. Descriptive epidemiology of World Health Organization grades II and III intracranial meningiomas in the United States. Neuro-oncology. 2015;17(8):1166-1173.
[4]Orton A, Frandsen J, Jensen R, Shrieve DC, Suneja G. Anaplastic meningioma: an analysis of the National Cancer Database from 2004 to 2012. Journal of neurosurgery. 2018;128(6):1684-1689.
[5]Nassiri F, Liu J, Patil V, et al. A clinically applicable integrative molecular classification of meningiomas. Nature. 2021;597(7874):119-125.
[6]Chen X, Chen Y, Chen X, et al. Single-cell RNA sequencing reveals intra-tumoral heterogeneity of glioblastoma and a pro-tumor subset of tumor-associated macrophages characterized by EZH2 overexpression. Biochim Biophys Acta Mol Basis Dis. 2022;1868(12):166534.
[7]Li L, Qiu P, Chen B, et al. Reactive oxygen species contribute to arsenic-induced EZH2 phosphorylation in human bronchial epithelial cells and lung cancer cells. Toxicol Appl Pharmacol. 2014;276(3):165-170.
[8]Wang J, Ma ZB, Li K, Guo GH. Association between EZH2 polymorphisms and colorectal cancer risk in Han Chinese population. Medical oncology (Northwood, London, England). 2014;31(3):874.
[9]Boyer LA, Plath K, Zeitlinger J, et al. Polycomb complexes repress developmental regulators in murine embryonic stem cells. Nature. 2006;441(7091):349-353.
[10]Margueron R, Reinberg D. The Polycomb complex PRC2 and its mark in life. Nature. 2011;469(7330):343-349.
[11]Laugesen A, Hojfeldt JW, Helin K. Molecular Mechanisms Directing PRC2 Recruitment and H3K27 Methylation. Mol Cell. 2019;74(1):8-18.
[12]Samal S, Patnaik A, Sahu F, Purkait S. Altered expression of epigenetic modifiers EZH2, H3K27me3, and DNA methyltransferases in meningiomas – prognostic biomarkers for routine practice. Folia Neuropathol. 2020;58(2):133-142.
[13]Harmanci AS, Youngblood MW, Clark VE, et al. Integrated genomic analyses of de novo pathways underlying atypical meningiomas. Nat Commun. 2018;9:16215.
[14]Pereira BJA, Marcondes Lerario A, Sola PR, et al. Impact of a cell cycle and an extracellular matrix remodeling transcriptional signature on tumor progression and correlation with EZH2 expression in meningioma. Journal of neurosurgery. 2022:1-14.